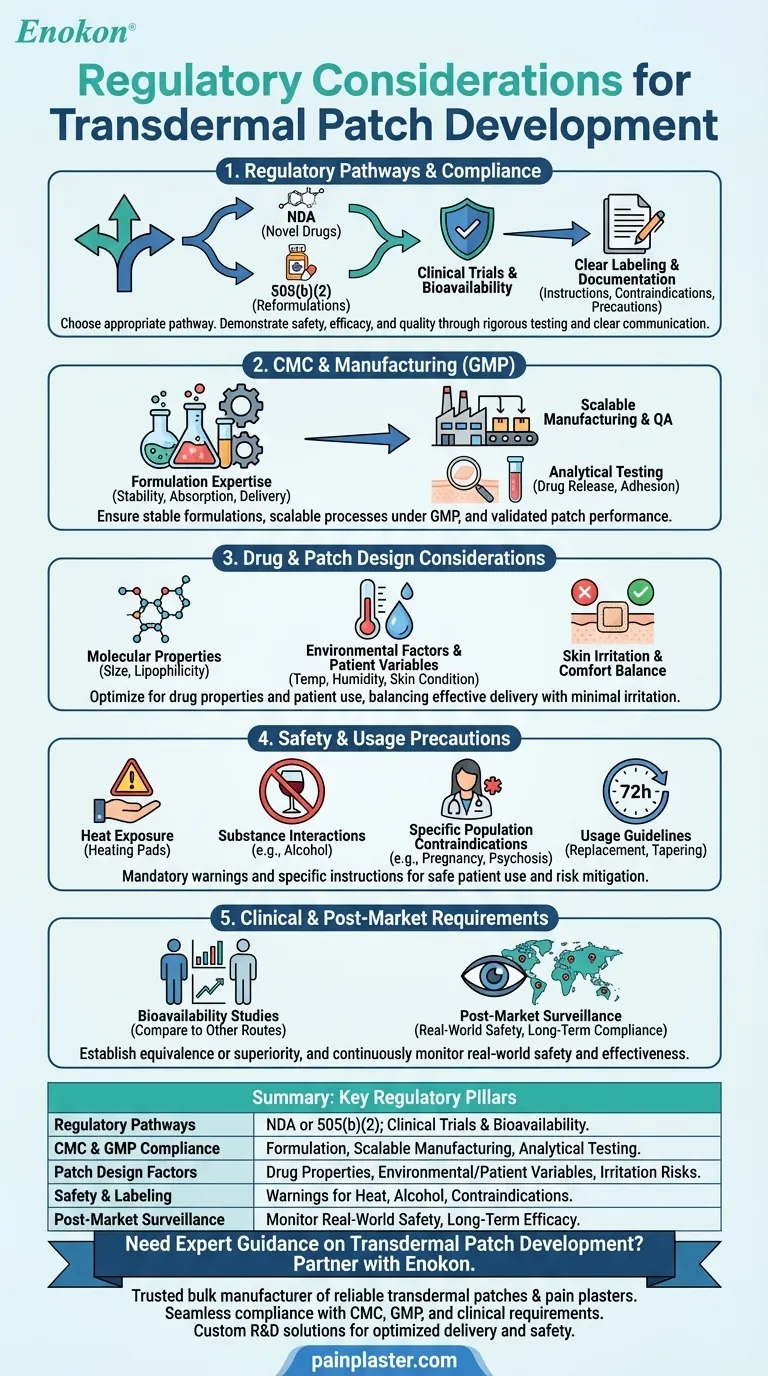
O desenvolvimento de adesivos transdérmicos envolve a navegação num cenário regulamentar complexo para garantir a segurança, a eficácia e a qualidade.As principais considerações incluem a conformidade com os requisitos químicos, de fabrico e de controlo (CMC), a adesão às Boas Práticas de Fabrico (BPF) e testes clínicos completos de biodisponibilidade e segurança.A conceção do penso deve ter em conta as propriedades do medicamento (por exemplo, tamanho molecular, polaridade) e os factores ambientais, enquanto a rotulagem e a documentação devem cumprir normas rigorosas.Podem aplicar-se vias regulamentares como as NDA ou 505(b)(2), dependendo da novidade do medicamento.Precauções como riscos de irritação da pele e restrições de uso (por exemplo, evitar a exposição ao calor) também devem ser abordadas para obter aprovação e garantir a segurança do paciente.

Pontos-chave explicados:
-
Vias regulamentares e conformidade
- Os promotores devem escolher entre um Pedido de Novo Medicamento (NDA) para novos medicamentos ou uma via 505(b)(2) para reformulações de medicamentos aprovados.
- Conformidade com adesivo transdérmico A regulamentação exige a demonstração de segurança, eficácia e qualidade através de ensaios clínicos, incluindo estudos de biodisponibilidade.
- A rotulagem e a documentação claras são obrigatórias, detalhando as instruções de utilização, as contra-indicações (por exemplo, psicose relacionada com demência) e as precauções (por exemplo, evitar a exposição ao álcool ou ao calor).
-
Química, fabrico e controlos (CMC)
- A experiência em formulação é fundamental para garantir a estabilidade, absorção e taxas de administração consistentes do medicamento.
- A escalabilidade e a garantia de qualidade durante o fabrico comercial devem estar em conformidade com as normas GMP.
- Os testes analíticos validam o desempenho do penso, incluindo os perfis de libertação do fármaco e as propriedades de adesão.
-
Considerações sobre a conceção do fármaco e do penso
- As propriedades moleculares (por exemplo, tamanho pequeno, lipofilicidade) influenciam as taxas de absorção e devem ser optimizadas durante o desenvolvimento.
- Os factores ambientais (temperatura, humidade) e as variáveis específicas do doente (estado da pele, idade) afectam a eficácia e exigem testes em condições realistas.
- Os pensos devem equilibrar a administração do medicamento com o conforto, minimizando a irritação da pele ou as reacções alérgicas.
-
Precauções de segurança e de utilização
- A rotulagem deve alertar para riscos como irritação da pele, exposição ao calor (por exemplo, almofadas de aquecimento) e interações com substâncias como o álcool.
- Populações específicas (grávidas/amamentando, pessoas com psicose) podem exigir contra-indicações.
- As diretrizes de utilização (por exemplo, substituição a cada 72 horas, protocolos de redução gradual) devem ser claramente comunicadas aos doentes.
-
Requisitos clínicos e pós-comercialização
- Os estudos de biodisponibilidade comparam a administração transdérmica com outras vias (por exemplo, oral) para estabelecer a equivalência ou superioridade.
- A vigilância pós-comercialização monitoriza a segurança no mundo real, garantindo a conformidade a longo prazo e abordando efeitos adversos imprevistos.
Ao abordar estas áreas, os criadores podem ultrapassar os obstáculos regulamentares e, ao mesmo tempo, fornecer terapias transdérmicas eficazes e fáceis de utilizar pelos doentes.Já pensou em como os adesivos podem evoluir para reduzir a irritação da pele sem comprometer a administração do medicamento?
Tabela de resumo:
| Principais considerações regulamentares | Detalhes |
|---|---|
| Vias de regulamentação | NDA para novos medicamentos; 505(b)(2) para reformulações.Requer ensaios clínicos e estudos de biodisponibilidade. |
| Conformidade CMC e GMP | Estabilidade da formulação, fabrico em escala e testes analíticos (libertação do fármaco, adesão). |
| Factores de conceção dos pensos | Otimizar as propriedades do medicamento (tamanho, lipofilicidade), variáveis ambientais/paciente e riscos de irritação da pele. |
| Segurança e rotulagem | Alertar para a exposição ao calor, interações com álcool e contra-indicações para populações de alto risco. |
| Vigilância pós-comercialização | Monitorizar a segurança no mundo real e a eficácia a longo prazo após a aprovação. |
Precisa de orientação especializada no desenvolvimento de adesivos transdérmicos? Faça parceria com a Enokon A Enokon, Inc., é um fabricante de confiança de adesivos transdérmicos e pensos analgésicos fiáveis para marcas e distribuidores de cuidados de saúde.A nossa experiência técnica assegura uma conformidade perfeita com os requisitos de CMC, GMP e testes clínicos, enquanto as nossas soluções personalizadas de I&D optimizam a administração de medicamentos e a segurança dos doentes. Contacte-nos hoje para discutir o seu projeto!
Guia Visual
Produtos relacionados
- Patches de calor infravermelho distante para alívio da dor Patches transdérmicos
- Pensos de aquecimento para aliviar as dores das cólicas menstruais
- Tapa-olhos Herbal Eye Protection Patch Tapa-olhos
- Patch de alívio da dor em gel de mentol
- Patch de alívio da dor Icy Hot Menthol Medicine
As pessoas também perguntam
- Que estudos adicionais são necessários relativamente à terapêutica com adesivos intermitentes de nitroglicerina?Principais lacunas de investigação explicadas
- Qual é o suporte clínico para o Pain Relief Patch?Alívio para a dor crónica baseado em evidências
- O que é que um estudo de 2020 descobriu sobre a eficácia do adesivo Kailo?Alívio rápido e seguro da dor
- Quais são as vantagens farmacocinéticas do adesivo de cetoprofeno?Alívio da dor direcionado com o mínimo de efeitos secundários
- Qual é o propósito técnico dos adesivos de placebo de alta simulação? Garanta a Integridade Clínica para Ensaios Transdérmicos
- Que adesivo alternativo é utilizado para os doentes idosos em vez do fentanilo? Alívio da dor mais seguro para os idosos
- Como uma camada de suporte compósita protege a integridade do adesivo? Soluções de folha de alumínio-polietileno para estabilidade de medicamentos.
- Quais são os potenciais inconvenientes da utilização de pensos tópicos para as dores nas costas?Riscos e dicas de mitigação

















