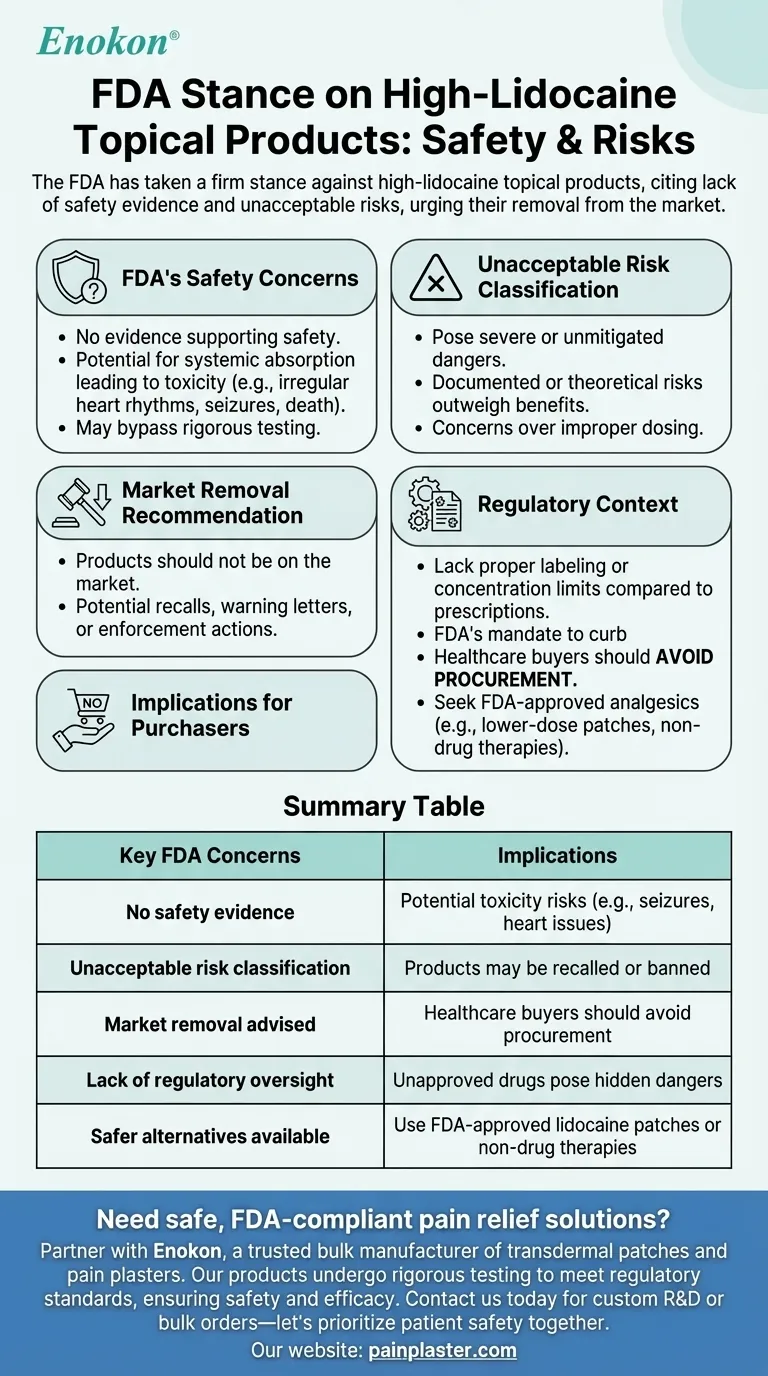
A FDA tomou uma posição firme contra os produtos tópicos com alto teor de lidocaína, citando a falta de provas da sua segurança e considerando-os como apresentando riscos inaceitáveis para os consumidores.A agência declara explicitamente que estes produtos não devem estar disponíveis no mercado devido aos potenciais perigos para a saúde.Esta posição reflecte preocupações sobre alegações de segurança não verificadas e o potencial de utilização indevida ou efeitos adversos, sublinhando a necessidade de uma supervisão regulamentar mais rigorosa para proteger a saúde pública.

Pontos-chave explicados:
-
Preocupações de segurança da FDA
- A FDA não tem nenhuma evidência que apoiem a segurança dos produtos tópicos com elevado teor de lidocaína.
- Esta falta de dados levanta questões sobre potenciais riscos, como a absorção sistémica que leva à toxicidade (por exemplo, ritmos cardíacos irregulares, convulsões ou mesmo a morte em casos extremos).
- A posição da agência implica que estes produtos podem passar ao lado dos testes rigorosos exigidos para os medicamentos aprovados, aumentando a incerteza sobre os seus efeitos.
-
Classificação de risco inaceitável
- A FDA classifica estes produtos como apresentando riscos inaceitáveis A designação "riscos inaceitáveis" é uma designação rara reservada a artigos com perigos graves ou não mitigados.
- Isto sugere que os acontecimentos adversos documentados ou os riscos teóricos (por exemplo, dosagem incorrecta devido à falta de normalização) ultrapassam quaisquer benefícios percebidos.
-
Recomendação de retirada do mercado
- A afirmação de que estes produtos não deveriam estar no mercado sublinha a abordagem proactiva da FDA à proteção dos consumidores.
- Isto pode levar a recolhas, cartas de aviso aos fabricantes ou acções de execução contra os distribuidores.
-
Contexto regulamentar
- Ao contrário da lidocaína sujeita a receita médica (que tem controlos de dosagem e supervisão clínica), os produtos OTC com elevado teor de lidocaína podem não ter uma rotulagem adequada ou limites de concentração.
- A posição da FDA está em consonância com o seu mandato de travar os medicamentos não aprovados que se fazem passar por remédios tópicos.
-
Implicações para os compradores
- Os compradores do sector da saúde devem evitar a aquisição de tais produtos até que mais provas ou reformulação resolvam as preocupações da FDA.
- Analgésicos alternativos aprovados pela FDA (por exemplo, adesivos de lidocaína em doses mais baixas ou terapias não medicamentosas) podem ser substitutos mais seguros.
O aviso da FDA serve como um lembrete crítico dos perigos ocultos em produtos OTC aparentemente benignos, instando tanto os consumidores como os profissionais a dar prioridade aos dados de segurança verificados em detrimento de alegações anedóticas.
Tabela de resumo:
| Principais preocupações da FDA | Implicações |
|---|---|
| Não há provas de segurança | Potenciais riscos de toxicidade (por exemplo, convulsões, problemas cardíacos) |
| Classificação de risco inaceitável | Os produtos podem ser recolhidos ou proibidos |
| Aconselha-se a retirada do mercado | Os compradores de produtos de saúde devem evitar aquisições |
| Falta de controlo regulamentar | Os medicamentos não aprovados representam perigos ocultos |
| Existem alternativas mais seguras | Use adesivos de lidocaína aprovados pela FDA ou terapias não medicamentosas |
Precisa de soluções de alívio da dor seguras e em conformidade com a FDA? Faça parceria com a Enokon A Enokon, um fabricante de confiança de adesivos transdérmicos e pensos analgésicos para distribuidores e marcas de cuidados de saúde.Os nossos produtos são submetidos a testes rigorosos para cumprir as normas regulamentares, garantindo a segurança e a eficácia. Contacte-nos hoje para I&D personalizada ou encomendas em massa - vamos dar prioridade à segurança dos doentes em conjunto.
Guia Visual
Produtos relacionados
- Patch de alívio da dor de hidrogel de lidocaína para alívio da dor
- Patches medicinais para alívio da dor com Capsaicina Chili
- Patches de calor profundo por infravermelhos distantes para alívio da dor Patches medicados para alívio da dor
- Pensos médicos de gel de arrefecimento para a febre Pensos de arrefecimento
- Patch de alívio da dor Icy Hot Menthol Medicine
As pessoas também perguntam
- O que são adesivos de lidocaína e como funcionam?Alívio da dor direcionado Explicação
- Para que são utilizados os pensos de lidocaína?Alívio específico da dor crónica e nervosa
- Quais são os potenciais efeitos secundários dos adesivos de lidocaína?Compreender os riscos para um alívio seguro da dor
- Existem provas sólidas que apoiem a eficácia dos pensos de lidocaína para as dores de costas?
- Quais são as instruções de aplicação dos pensos de lidocaína?Guia para o alívio seguro e eficaz da dor
















