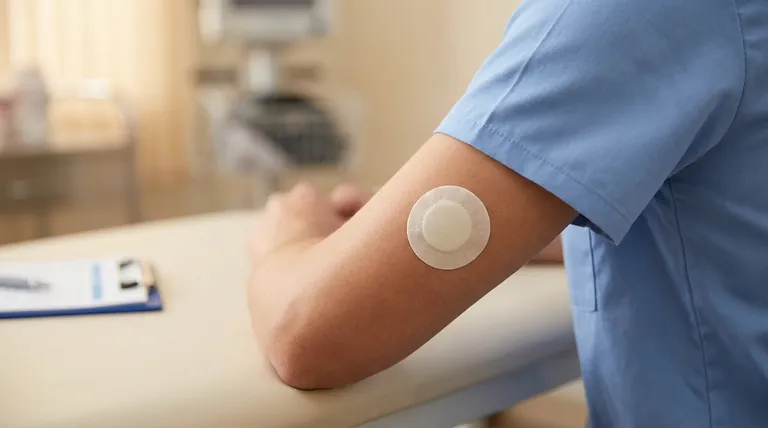
A aprovação pela FDA do Asenapine Patch (asenapina transdérmica) foi apoiado por uma combinação de dados de eficácia anteriores de estudos de asenapina sublingual e um ensaio principal de 6 semanas, em dupla ocultação, controlado por placebo, que envolveu 607 adultos internados com esquizofrenia.A formulação transdérmica demonstrou melhorias estatisticamente significativas nos pontos finais primários (pontuações PANSS) e secundários (classificações CGI-S) em comparação com o placebo, confirmando o seu benefício terapêutico.Estas evidências estabeleceram coletivamente a segurança, a eficácia e a relevância clínica do adesivo para o tratamento da esquizofrenia.
Pontos-chave explicados:
-
Dados anteriores sobre a eficácia da asenapina sublingual
- Ensaios anteriores que avaliaram a asenapina sublingual forneceram evidências fundamentais do mecanismo de ação do medicamento e do potencial terapêutico na esquizofrenia.
- Esses estudos provavelmente informaram a dosagem, os perfis de segurança e os resultados esperados para a formulação transdérmica, agilizando o caminho da aprovação.
-
Ensaio principal em dupla ocultação de 6 semanas
- Desenho do estudo:Um ensaio rigoroso, controlado por placebo, com 607 participantes, assegurou um poder estatístico robusto e minimizou o enviesamento.
- População:Centrado em doentes adultos internados com esquizofrenia, reflectindo a demografia alvo para utilização clínica.
- Duração:O período de 6 semanas equilibrou a avaliação dos sintomas agudos com a aplicabilidade clínica prática.
-
Ponto final primário:Pontuações PANSS
- A Escala de Síndrome Positiva e Negativa (PANSS) é um padrão de ouro para avaliar a gravidade dos sintomas da esquizofrenia.
- Melhorias estatisticamente significativas nas pontuações da PANSS confirmaram a eficácia do adesivo na redução dos sintomas positivos (por exemplo, alucinações) e negativos (por exemplo, retraimento social).
-
Ponto final secundário:Classificações CGI-S
- A escala Clinical Global Impression-Severity (CGI-S) forneceu uma validação da melhoria dos sintomas relatada pelo médico.
- A significância aqui reforçou os benefícios clínicos observáveis e específicos do paciente.
-
Segurança e tolerabilidade
- Embora não seja explicitamente detalhada nas referências, a aprovação da FDA implica que a formulação transdérmica cumpriu os parâmetros de segurança, provavelmente aproveitando os dados da via sublingual e os relatórios de eventos adversos de novos ensaios.
- A administração transdérmica pode oferecer vantagens como a redução dos efeitos secundários sistémicos (por exemplo, em comparação com as vias oral ou injetável).
-
Fundamentação regulamentar
- A decisão da FDA baseou-se numa eficácia reprodutível (PANSS/CGI-S) e num perfil claro de risco-benefício, apoiado por dados de ensaios controlados.
- Os benefícios do adesivo em termos de conveniência e adesão (por exemplo, libertação sustentada, via não oral) podem ter justificado ainda mais a aprovação para uma população frequentemente afetada pelo cumprimento da medicação.
Para os compradores de cuidados de saúde, esta evidência sublinha a importância da adesivo de asenapina como uma opção viável e comprovada para o tratamento da esquizofrenia, com potenciais vantagens em termos de administração e tolerabilidade.Será que o seu formato transdérmico se alinha com as necessidades dos seus doentes ou com os protocolos institucionais?
Tabela de resumo:
| Principais provas para a aprovação da FDA | Detalhes |
|---|---|
| Dados anteriores sobre a asenapina sublingual | Mecanismo de ação e perfil de segurança estabelecidos |
| Ensaio principal de 6 semanas | 607 adultos com esquizofrenia, em regime de internamento, em dupla ocultação, controlado por placebo |
| Ponto final primário (pontuações PANSS) | Redução estatisticamente significativa dos sintomas |
| Ponto final secundário (classificações CGI-S) | Melhoria da gravidade confirmada pelo médico |
| Segurança e tolerabilidade | Cumpre os padrões de referência da FDA, potenciais benefícios de adesão |
| Fundamentação regulamentar | Eficácia reprodutível e perfil de risco-benefício claro |
Interessado em integrar a asenapina transdérmica nos seus protocolos de tratamento?
Como fabricante de confiança de adesivos transdérmicos e pensos para a dor, Enokon oferece soluções fiáveis e clinicamente validadas para distribuidores de cuidados de saúde e marcas farmacêuticas.A nossa experiência em I&D personalizada assegura formulações adaptadas às necessidades dos seus doentes.
Contacte-nos hoje para discutir oportunidades de parceria ou solicitar amostras de produtos.
Guia Visual
Produtos relacionados
- Adesivo para o alívio da tosse e das dores provocadas pela asma para adultos e crianças
- Patch de alívio da dor em gel de mentol
- Patch de alívio da dor Icy Hot Menthol Medicine
- Patches de calor profundo por infravermelhos distantes para alívio da dor Patches medicados para alívio da dor
- Tapa-olhos Herbal Eye Protection Patch Tapa-olhos
As pessoas também perguntam
- Os pensos analgésicos são seguros para peles sensíveis?Como utilizá-los com segurança
- As mulheres grávidas podem utilizar pensos analgésicos?Segurança e alternativas explicadas
- Como é que a capsaicina actua no Reliever Patch?Uma solução sem fármacos para o alívio direcionado da dor
- Que tipos de tosse podem ser tratados com o adesivo infravermelho distante para alívio da tosse?Alívio natural para a tosse seca, húmida e persistente
- Que papel desempenham os ingredientes naturais e a estimulação dos pontos de acupunctura no penso para o alívio da tosse?Alívio de dupla ação para o bem-estar respiratório















