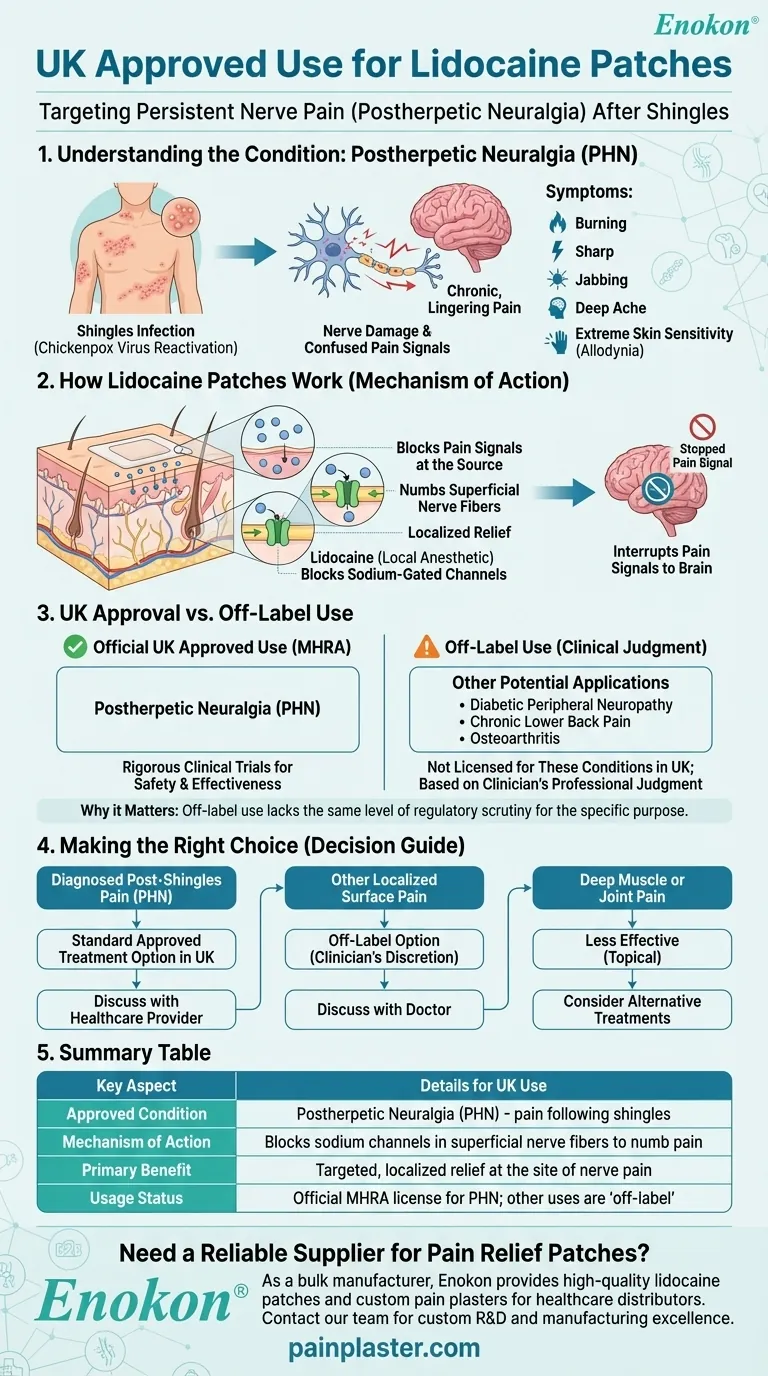
No Reino Unido, os adesivos de lidocaína são especificamente aprovados para o tratamento da nevralgia pós-herpética (NPH), uma condição de dor nervosa persistente que pode ocorrer após uma infeção por herpes-zóster.Embora a investigação sugira potenciais utilizações não autorizadas para outras condições de dor, a aprovação do Reino Unido centra-se estritamente no tratamento da NPH.Isto difere ligeiramente das aprovações mais amplas da FDA, reflectindo as distinções regulamentares regionais nas abordagens ao tratamento da dor.

Pontos-chave explicados:
-
Indicação primária aprovada no Reino Unido
- Os adesivos de lidocaína estão aprovados exclusivamente para a nevralgia pós-herpética (NPH) no Reino Unido.
- A NPH é uma síndrome de dor neuropática após o herpes zoster (infeção por herpes zoster), caracterizada por dor persistente em áreas da pele previamente afectadas.
-
Mecanismo de ação da PHN
- Os adesivos administram lidocaína localizada (concentração de 5%) para bloquear sinais nervosos anormais em nervos periféricos danificados.
- A aplicação tópica minimiza a absorção sistémica, reduzindo os efeitos secundários em comparação com os analgésicos orais.
-
Contexto regulamentar
- A aprovação no Reino Unido está em conformidade com o quadro da Agência Europeia de Medicamentos (EMA), que normalmente exige provas clínicas sólidas para indicações específicas.
- Ao contrário da FDA, as entidades reguladoras do Reino Unido/UE não alargaram a aprovação a outras condições de dor neuropática (por exemplo, neuropatia diabética), apesar da investigação emergente.
-
Considerações clínicas
- Os pensos são aplicados diretamente na pele intacta sobre as áreas dolorosas durante um máximo de 12 horas/dia.
- As contra-indicações incluem hipersensibilidade à lidocaína ou aos componentes do adesivo.
-
Potencial de utilização não indicada
- Embora não esteja aprovado no Reino Unido, os estudos registam eficácia na osteoartrite, dores crónicas nas costas e dores pós-cirúrgicas.
- Os prescritores podem considerar a utilização não autorizada com base nas necessidades individuais dos doentes e na avaliação dos riscos e benefícios.
-
Implicações para a aquisição
- As aquisições no sector da saúde devem dar prioridade às formulações verificadas e aprovadas pelo Reino Unido para o tratamento da PHN.
- Para investigação ou aplicações alargadas, os protocolos institucionais podem exigir uma justificação adicional.
A aprovação específica do Reino Unido reflecte uma abordagem cautelosa ao tratamento da dor neuropática, enfatizando a utilização baseada em provas para a NPH, reconhecendo simultaneamente um potencial terapêutico mais amplo através da investigação em curso.
Quadro de resumo:
| Aspeto-chave | Pormenores |
|---|---|
| Condição aprovada | Neuralgia pós-herpética (NPH) apenas |
| Mecanismo de ação | Administração localizada de lidocaína a 5% para bloquear sinais nervosos anormais |
| Diretrizes de aplicação | Aplicar na pele intacta durante ≤12 horas/dia; evitar zonas hipersensíveis |
| Âmbito regulamentar | Aprovação alinhada com a EMA (sem extensão no Reino Unido para outras condições de dor neuropática) |
| Potencial não indicado | Osteoartrite, dor crónica nas costas (requer critério do prescritor) |
Precisa de adesivos de lidocaína fiáveis para o tratamento da PHN? Como um fabricante de confiança de soluções transdérmicas para o alívio da dor, Enokon oferece:
- Formulações compatíveis com o Reino Unido para o tratamento da nevralgia pós-herpética
- Apoio personalizado de I&D para distribuidores e marcas de cuidados de saúde
- Produção certificada pelas BPF garantindo uma qualidade e eficácia consistentes
Contacte a nossa equipa para discutir as necessidades de aquisição ou desenvolvimento hoje mesmo!
Guia Visual
Produtos relacionados
- Patch de alívio da dor de hidrogel de lidocaína para alívio da dor
- Patches medicinais para alívio da dor com Capsaicina Chili
- Patches de calor profundo por infravermelhos distantes para alívio da dor Patches medicados para alívio da dor
- Adesivo para o alívio da tosse e das dores provocadas pela asma para adultos e crianças
- Pensos de aquecimento para aliviar as dores das cólicas menstruais
As pessoas também perguntam
- Que precauções devem ser tomadas quando se utiliza lidocaína tópica?Dicas de segurança essenciais para um alívio eficaz da dor
- O penso Lidoderm pode ser cortado à medida?Personalizar para um alívio da dor direcionado
- Qual é a recomendação para a utilização de lidocaína tópica durante a amamentação?Diretrizes de utilização segura para mães a amamentar
- Qual foi o objetivo do estudo sobre os pensos medicados com lidocaína a 5% para a nevralgia pós-herpética?
- Qual é a função da camada de suporte de feltro de poliéster não tecido? Descubra o Segredo dos Adesivos Eficazes de Lidocaína
- Quais são as vantagens do uso de adesivos de Lidocaína a 5%? Alívio Direcionado para Dor de Lesão da Medula Espinhal
- Qual é o objetivo do estudo sobre pensos medicados com lidocaína a 5%?Avaliar o alívio da dor e a qualidade de vida
- O que dizem os estudos sobre a eficácia dos pensos de lidocaína para a dor lombar crónica?
















